Termodinamika
Pengertian Termodinamika
Termodinamika berasal dari
bahasa Yunani dimana Thermos yang artinya panas dan Dynamic yang artinya
perubahan. Termodinamika adalah suatu ilmu yang menggambarkan usaha
untuk mengubah kalor (perpindahan energi yang disebabkan perbedaan suhu)
menjadi energi serta sifat-sifat pendukungnya. Termodinamika berhubungan erat
dengan fisika energi, panas, kerja, entropi dan kespontanan proses.
Termodinamika juga berhubungan dengan mekanika statik. Cabang ilmu fisika ini
mempelajari suatu pertukaran energi dalam bentuk kalor dan kerja, sistem
pembatas dan lingkungan. Aplikasi dan penerapan termodinamika bisa terjadi pada
tubuh manusia, peristiwa meniup kopi panas, perkakas elektronik, Refrigerator,
mobil, pembangkit listrik dan industri.
Prinsip
Termodinamika
Prinsip
termodinamika sebenarnya yaitu hal alami yang terjadi dalam kehidupan
sehari-hari. Dengan berkembangnya ilmu pengetahuan dan teknologi, termodinamika
direkayasa sedemikian rupa sehingga menjadi suatu bentuk mekanisme yang bisa
membantu manusia dalam kegiatannya. Aplikasi termodinamika yang begitu luas
dimungkinkan karena adanya perkembangan ilmu termodinamika sejak abad 17.
Pengembangan ilmu termodinamika dimulai dengan pendekatan makroskopik yakni
perilaku umum partikel zat yang menjadi media pembawa energi.
Sistem-Sistem Termodinamika
Klasifikasi sistem termodinamika
berdasarkan sifat dari batasan dan arus benda, energi dan materi yang
melaluinya. Ada tiga jenis sistem berdasarkan jenis pertukaran yang terjadi
antara sistem dan lingkungannya, yakni sebagai berikut :
1. Sistem terbuka
Sistem yang menyebabkan terjadinya
pertukaran energi (panas dan kerja) dan benda (materi) dengan lingkungannya.
Sistem terbuka ini meliputi peralatan yang melibatkan adanya suatu aliran massa
kedalam atau keluar sistem seperti pada kompresor, turbin, nozel dan motor
bakar. Sistem mesin motor bakar yaitu ruang didalam silinder mesin, dimana
campuran bahan bahan bakar dan udara masuk kedalam silinder, dan gas buang
keluar sistem. Pada sistem terbuka ini, baik massa maupun energi
bisa melintasi batas sistem yang sifatnya permeabel. Dengan demikian, pada
sistem ini volume dari sistem tidak berubah sehingga disebut juga dengan
control volume.
Perjanjian yang kita gunakan untuk
menganalisis sistem yaitu :
- Untuk panas (Q) bernilai positif
jika diberikan kepada sistem dan bernilai negatif bila keluar dari
sistem
- Untuk usaha (W) bernilai positif jika keluar dari
sistem dan bernilai negatif jika diberikan (masuk) kedalam sistem.
2. Sistem tertutup
Sistem yang mengakibatkan terjadinya
pertukaran energi (panas dan kerja) tetapi tidak terjadi pertukaran zat dengan
lingkungan. Sistem tertutup terdiri atas suatu jumlah massa yang tertentu
dimana massa ini tidak bisa melintasi lapis batas sistem. Tetapi, energi baik
dalam bentuk panas (heat) maupun usaha (work) bisa melintasi lapis batas
sistem tersebut. Dalam sistem tertutup, walaupun massa tidak bisa berubah
selama proses berlangsung, tapi volume bisa saja berubah disebabkan
adanya lapis batas yang bisa bergerak (moving boundary) pada salah satu
bagian dari lapis batas sistem tersebut. Contoh sistem tertutup
yaitu suatu balon udara yang dipanaskan, dimana massa udara didalam balon
tetap, tetapi volumenya berubah dan energi panas masuk kedalam masa udara didalam
balon.
Suatu sistem bisa mengalami
pertukaran panas atau kerja atau keduanya, biasanya dipertimbangkan sebagai
sifat pembatasnya:
- Pembatas
adiabatik: tidak
memperbolehkan pertukaran panas.
- Pembatas
rigid: tidak
memperbolehkan pertukaran kerja.
Dikenal juga istilah dinding, ada
dua jenis dinding yaitu dinding adiabatik dan dinding diatermik. Dinding
adiabatik yaitu dinding yang menyababkan kedua zat mencapai suhu yang
sama dalam waktu yang lama (lambat). Untuk dinding adiabatik sempurna tidak
memungkinkan terjadinya suatu pertukaran kalor antara dua zat. Sedangkan
dinding diatermik yaitu dinding yang memungkinkan kedua zat mencapai suhu
yang sama dalam waktu yang singkat (cepat).
3. Sistem terisolasi
Sistem terisolasi ialah sistem yang
menyebabkan tidak terjadinya pertukaran panas, zat atau kerja dengan
lingkungannya. Contohnya : air yang disimpan dalam termos dan tabung gas yang
terisolasi. Dalam kenyataan, sebuah sistem tidak bisa terisolasi sepenuhnya
dari lingkungan, karena pasti ada terjadi sedikit pencampuran,
walaupun hanya penerimaan sedikit penarikan gravitasi. Dalam analisis
sistem terisolasi, energi yang masuk ke sistem sama dengan energi yang keluar
dari sistem.
Karakteristik yang menentukan sifat
dari sistem disebut dengan property (koordinat sistem/variabel keadaan sistem),
seperti tekanan (p), temperatur (T), volume (v), masa (m), viskositas, konduksi
panas dan lain-lain. Selain itu ada juga koordinat sistem yang didefinisikan
dari koordinat sistem yang lainnya seperti, berat jenis, volume spesifik, panas
jenis dan lain-lain. Suatu sistem bisa berada pada suatu kondisi yang tidak
berubah, jika masing-masing jenis koordinat sistem tersebut bisa diukur pada
semua bagiannya dan tidak berbeda nilainya. Kondisi tersebut disebut sebagai
keadaan (state) tertentu dari sistem, dimana sistem memiliki nilai
koordinat yang tetap. Jika koordinatnya berubah, maka keadaan sistem tersebut
disebut mengalami perubahan keadaan. Suatu sistem yang tidak mengalami
perubahan keadaan disebut sistem dalam keadaan seimbang (equilibrium).
Hukum-Hukum
Termodinamika
Termodinamika mempunyai hukum-hukum
pendukungnya. Hukum-hukum ini menerangkan bagaimana dan apa saja konsep yang
harus diperhatikan. Seperti peristiwa perpindahan panas dan kerja pada proses
termodinamika. Sejak perumusannya, hukum-hukum ini sudah menjadi hukum penting
dalam dunia fisika yang berhubungan dengan termodinamika. Penerapan hukum-hukum
ini juga digunakan dalam berbagai bidang seperti bidang ilmu lingkungan,
otomotif, ilmu pangan, ilmu kimaia dan lain-lain. Berikut hukum-hukum
termodinamika :
1. Hukum I
termodinamika (Kekekalan Energi dalam Sistem)
Energi tidak
bisa diciptakan maupun dimusnahkan. Manusia hanya bisa mengubah
bentuk energi dari bentuk energi satu ke energi lainnya. Dalam termodinamika,
jika sesuatu diberikan kalor, maka kalor tersebut akan berguna untuk usaha luar
dan mengubah energi dalam.
Bunyi Hukum I Termodinamika
Bunyi Hukum I Termodinamika
“untuk setiap proses apabila kalor Q
diberikan kepada sistem dan sistem melakukan usaha W, maka akan terjadi
perubahan energi dalam ΔU = Q – W”.
Dimana U menunjukkan sifat
dari sebuah sistem, sedangkan W dan Q tidak. W dan Q bukan fungsi Variabel
keadaan, tetapi termasuk dalam proses termodinamika yang bisa merubah keadaan.
U merupakan fungsi variabel keadaan (P,V,T,n).
W bertanda positif bila sistem melakukan usaha terhadap lingkungan dan negatif jika menerima usaha lingkungan.
W bertanda positif bila sistem melakukan usaha terhadap lingkungan dan negatif jika menerima usaha lingkungan.
Q bertanda positif jika sistem menerima kalor
dari lingkungan dan negatif jika melepas kalor pada lingkungan.
Perubahan energi dari sebuah sistem hanya tergantung pada transfer panas ke dalam sistem dan kerja yang dilakukan oleh sistem dan tidak bergantung pada proses yang terjadi. Pada hukum ini tidak ada petunjuk adanya arah perubahan dan batasan-batasan lain.
Perubahan energi dari sebuah sistem hanya tergantung pada transfer panas ke dalam sistem dan kerja yang dilakukan oleh sistem dan tidak bergantung pada proses yang terjadi. Pada hukum ini tidak ada petunjuk adanya arah perubahan dan batasan-batasan lain.
2. Hukum II
termodinamika (Arah reaksi sistem dan batasan)
Hukum kedua ini membatasi
perubahan energi mana yang bisa terjadi dan yang tidak. Pembatasan ini
dinyatakan dengan berbagi cara, yaitu :
“Hukum II termodinamika dalam menyatakan aliran
kalorKalor mengalir secara spontan dari benda bersuhu tinggi ke benda bersuhu
rendah dan tidak mengalir secara spontan dalam arah kebalikannya”
Hukum II termodinamika dalam
pernyataan tentang mesin kalor
Tidak mungkin membuat suatu mesin kalor yang bekerja dalam suatu siklus yang semata-mata menyerap kalor dari sebuah reservoir dan mengubah seluruhnya menjadi usaha luar.
Tidak mungkin membuat suatu mesin kalor yang bekerja dalam suatu siklus yang semata-mata menyerap kalor dari sebuah reservoir dan mengubah seluruhnya menjadi usaha luar.
Hukum II termodinamika dalam
pernyataan entropi (besaran termodinamika yang menyertai suatu perubahan setiap
keadaan dari awal sampai akhir sistem dan menyatakan ketidakteraturan suatu
sistem)
Total entropi semesta tidak berubah ketika proses reversibel terjadi dan bertambah ketia proses irreversible terjadi.
Total entropi semesta tidak berubah ketika proses reversibel terjadi dan bertambah ketia proses irreversible terjadi.
3. Hukum III
termodinamika (nol derajat)
Hukum ketiga termodinamika terkait dengan temperatur nol absolut. Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut (temperatur Kelvin) semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum.hukum ini jugga menyatakn bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.
Hukum ketiga termodinamika terkait dengan temperatur nol absolut. Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut (temperatur Kelvin) semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum.hukum ini jugga menyatakn bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.
Proses-proses Termodinamika
Proses termodinamika terbagi menjadi empat macam, tergantung dari keadaan tekanan, volume, dan suhu saat terjadinya proses tersebut. Proses-proses tersebut umumnya digambarkan dalam diagram P-V, yaitu diagram yang menggambarkan tekanan (P) dan volume (V) saat proses terjadi. Ada dua hal penting yang harus diingat dari berbagai jenis proses-proses termodinamika, yaitu variabel yang berubah dan usaha yang dilakukan. Usaha yang terjadi pada suatu proses termodinamika dapat diketahui dengan menghitung luasan grafik P-V.
Isobarik
Isobarik adalah proses termodinamika yang tidak mengubah nilai tekanan sistem (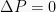 ). Nilai usaha dapat dihitung dengan persamaan berikut.
). Nilai usaha dapat dihitung dengan persamaan berikut.
Dari rumus tersebut, diketahui juga bahwa apabila volume membesar (terjadi pemuaian) maka usaha bernilai positif, dan bila volume mengecil (terjadi penyusutan) maka usaha bernilai negatif.

Sumber gambar: figures.boundless-cdn.com
Isokhorik
Isokhorik adalah proses termodinamika yang tidak mengubah nilai volume sistem ( ). Pada proses ini, nilai usaha adalah 0 karena tidak terdapat suatu luasan bangun yang terdapat pada gambar P-V.
). Pada proses ini, nilai usaha adalah 0 karena tidak terdapat suatu luasan bangun yang terdapat pada gambar P-V.

Sumber gambar: cft.fis.uc.pt
Isotermik
Isotermik adalah proses termodinamika yang tidak mengubah nilai suhu sistem (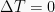 ).
).

Sumber gambar: bu.edu
Nilai usaha pada proses isotermik dinyatakan dengan persamaan berikut:
Dimana n adalah jumlah zat yang dinyatakan dengan satuan mol, R adalah konstanta gas, dan T adalah suhu. Rumus ini didapatkan dengan menggabungkan persamaan usaha di diagram P-V dengan persamaan gas ideal.
Adibatik
Adiabatik adalah proses termodinamika yang tidak mengubah nilai kalor sistem ( ).
).

Sumber gambar: gsu.edu
Pada gas monoatomic, usaha yang dilakukan pada proses adiabatik dapat dinyatakan dengan persamaan:
Jika diperhatikan dengan sekilas, proses adiabatik dan isotermik memiliki diagram P-V yang serupa. Secara detil, dapat dilihat bahwa proses adiabatik memiliki kemiringan yang lebih curam dibandingkan proses isotermik seperti contoh grafik berikut.

i.stack.imgur.com
Jika semua proses tersebut digambarkan menjadi suatu diagram P-V, dapat didapatkan grafik berikut. Patut diingat bahwa satuan-satuan yang digunakan dalam perhitungan adalah Satuan Internasional. Sebagai contoh, satuan untuk suhu yang digunakan adalah Kelvin, satuan untuk volume adalah m3, dan satuan untuk jumlah zat adalah mol.


Tidak ada komentar:
Posting Komentar